Амінокислоти
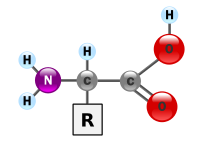
Загальна схема α-амінокислоти в неіонізованій формі
У залежності від того, до якого атому вуглецю приєднана аміно- група, амінокислоти поділяються на α-, β-, γ- і тощо. α-атомом вважається той атом карбону, до якого приєднана карбоксильна група, якщо біля нього ж розташована й аміногрупа, така амінокислота називається α-амінокислотою. Якщо аміногрупа приєднана до наступного (β) атома карбону, це буде β-амінокислота і так далі. Всі протеїногенні амінокислоти є α-амінокислотами.
Номенклатура
Кожна із двадцяти стандартних, і багато нестандартних, амінокислот мають тривіальні назви. Частина цих назв пов'язана із джерелами, з яких вперше було виділено сполуку: наприклад, аспарагін виділений зі спаржі (лат. Asparagus), глутамін — з глютену пшениці, тирозин — із сиру (сир грецькою tyros). Для скороченого запису протеїногенні амінокислоти позначають трибуквенним кодом, використовуючи перші три літери тривіальної назви (за винятком аспарагіну (Асн), глутаміну (Глн), ізолейцину (Іле) і триптофану (Трп), для останнього використовують також скорочення Три). Інколи також використовують позначення Asx і Glx, що означають «аспрарагінова кислота або аспарагін» і «глутамінова кислота або глутамін». Існування таких позначень пояснюється тим, що під час гідролізу пептидів у лужних або кислих середовищах аспарагін і глутамін дуже легко перетворюються у відповідні кислоти, через що часто неможливо точно визначити, яка саме амінокислота була у складі пептиду без застосування особливих підходів.У час появи біоінформатики ЕОМ використовували перфокарти, через що з'явилась потреба записувати амінокислотні послідовності більш компактно. Для цього Маргарет Оуклі Дейгофф розробила однобуквенну номенклатуру. Для позначення шести амінокислот використані їх початкові літери (в англійській мові), оскільки вони є унікальними (CHIMSV). Ще у п'яти (AGLPT) перші букви не унікальними, але позначають більш розповсюджені амінокислоти (наприклад, літера L позначає лейцин, оскільки він зустрічається частіше ніж лізин). Ще для чотирьох використані фонетично навідні літери (RFYW: R — aRginine, F — Fenilalanine, Y — tYrosine, W — tWiptophan), для чотирьох — букви, які є в складі їх назв, або можна там почути (DNEQ: D — asparDic acid, N — asparagiNe, E — glutamEke acid, Q — Q-tamin). Лізин позначають літерою K, оскільки в алфавіті вона найближча до L.
Хімічна будова
Усі амінокислоти містять карбоксильну й аміногрупи. В α-амінокислот вони приєднані до одного і того ж атома карбону. Решту молекули називають бічним ланцюгом або R-групою. Ці групи відрізняються за розміром, формою, гідрофільністю, електричним зарядом, схильністю формувати водневі зв'язки і загальною реакційною здатністю надаючи кожній амінокислоті унікальних властивостей. У найменшої амінокислоти — гліцину — бічного ланцюга немає, біля α-атома карбону крім каброксильної і аміногрупи розташовані два атоми водню.Оптична ізомерія
l- і d-ізомери гліцеральдегіду та аланіну
Молекули l- і d-аланіну
Для позначення абсолютної конфігурації чотирьох груп навколо хірального атома карбону використовується d/l система номенклатури розроблена Емілем Фішером. Він взяв за основу тріозу гліцеральдегід. Сполуки, які мають абсолютну конфігурацію схожу до такої в l-гліцеральдегіду називаються l-ізомерами, до d-гліцеральдегіду — d-ізомерами. Хоча історично літери l і d використовувались як скорочення від levorotatory (лівообертаючий) і dextrorotatory (правообертаючий), проте не всі l-амінокилсоти обертають площину поляризації світла вліво і навпаки.
Майже всі білки містять тільки l-ізомери амінокислот. d-амінокислоти знайдені в складі деяких поліпептидів, що утворюються в організмі морських черевоногих молюсків конусів, та в складі клітинних стінок бактерій і деяких пептидних антибіотиків. Для формування стабільних повторюваних структур у білках необхідно, щоб усі амінокислоти, що входять до їх складу, були представлені тільки одним енантіомером — l або d. На відміну від звичайних хімічних реакцій, в яких переважно утворюються рацемічні суміші стереоізомерів, продуктами реакцій біосинтезу в клітинах є тільки одна із форм. Такого результату досягається завдяки ферментам, що мають несиметричні активні центри, а отже є стереоспецифічними.
Класифікація на основі полярності бічних ланцюгів
Властивості амінокислотних залишків у складі білків є вирішальними для структури і функціонування останніх. Зокрема амінокислоти суттєво відрізняються за полярністю бічних ланцюгів, а отже і особливостями взаємодії із молекулами води. На основі цих відмінностей протеїногенні амінокислоти поділяють на чотири групи: амінокислоти із неполярними бічними ланцюгами, амінокислоти із полярними незарядженими бічними ланцюгами (інколи розділяють на амінокислоти із неполярними аліфатичними та неполярними циклічними бічними ланцюгами), амінокислоти із позитивно зарядженими бічними ланцюгами та амінокислоти із негативно зарядженими бічними ланцюгами (інколи останні дві групи об'єднують в одну).Амінокислоти із неполярними бічними групами
У цю групу об'єднують дев'ять амінокислот, бічні групи яких є неполярними і гідрофобними. Найменшою з них є гліцин, що не має бічного ланцюга (біля α-атома крабону крім карбоксильної і аміногрупи розміщені два атоми водню). Хоч гліцин класифікують як неполярну амінокислоту, він не робить ніякого внеску у забезпечення гідрофобних взаємодій в молекулах білків. Аланін, лейцин та ізолейцин мають аліфатичні вуглеводневі бічні групи: метильну, бутильну та ізобутильну відповідно. Метіонін є сірковмісною амінокислотою, його бічний ланцюг представлений неполярним тіоловим естером. Імінокислота пролін містить характерну піролідинову циклічну структуру, в складі якої вторинна аміногрупа (іміногрупа) утримується у фіксованій конформації. Через це ділянки поліпепдиних ланцюгів, що містять пролін є найменш гнучкими. До складу молекул фенілаланіну і триптофану входять громіздкі неполярні циклічні бічні групи: фенільна та індольна.Амінокислоти із неполярними бічними ланцюгами роблять внесок у структуру поліпептидів завдяки гідрофобним взаємодіям. Наприклад, у складі водорозчинних глобулярних білків вони згруповуються всередині молекули. Неполярні групи цих амінокислот також утворюють поверхні контакту інтегральних мембранних білків із гідрофобними частинами ліпідних мембран.
Амінокислоти із полярними незарядженими бічними групами
Шість амінокислот мають полярні незаряджені бічні ланцюги: серин, треонін, тирозин, цистеїн, аспарагін і глутамін. Серин і теронін містять гідроксильну групу, аспарагін і глутамін — амідну, тирозин — фенольну. До складу цистеїну входить тіольна гурпа -SH, завдяки чому дві молекули (чи їх залишки у складі пептидів) цієї речовини можуть з'єднуватись дисульфідним зв'язком, що формується шляхом окиснення -SH груп. Такі зв'язки важливі для формування і підтримання структури білків. Оскільки дві молекули цистеїну з'єднані дисульфідним зв'язком раніше вважались окремою амінокислотою, таку сполуку називали цистином, тепер цей термін вживається рідко.Амінокислоти із негативно зарядженими бічними групами
Дві амінокислоти мають сумарний негативний заряд за фізіологічного pH (7,0): аспарагінова і глутамінова кислоти. Обидві мають по додатковій карбоксильній групі. Їхні іонізовані форми називають аспартатом та глутаматом відповідно. Аміди цих амінокислот — аспрагін і глутамін також входять до складу білків.Амінокислоти із позитивно зарядженими бічними групами
Три протеїногенні амінокислоти мають позитивно заряджені бічні групи при фізіологічних значеннях pH: лізин, аргінін і гістидин. Лізин має додаткову первинну аміногрупу в ε-положенні. До складу аргініну входить гуанідинове угрупування, а гістидин містить імідазолове кільце. Серед усіх протеїногенних амінокислот тільки гістидин має групу, що іонізується за фізіологічного pH (pKa = 6,0). Через це його бічний ланцюг при pH 7,0 може бути нейтральним або позитивно зарядженим. Завдяки цій властивості гістидин входить до складу активних центрів багатьох ферментів, і бере участь у каталізі хімічних реакцій як донор/акцептор протонів.Властивості стандартних амінокислот
| [показати]Властивості стандартних амінокислот |
|---|
«Нестандартні» амінокислоти
Крім 20 «стандартних» амінокислот, що кодуються генетичним кодом, у живих організмах також трапляється велика кількість так званих нестандартних амінокислот.У складі готових поліпептидних ланцюгів деякі залишки амінокислот можуть модифікуватись. Таким чином, наприклад, утворюються нестандарнті амінокислоти 5-гідроксилізин і 4-гідроксипролін. Обидві входять до складу білка сполучної тканини колагену, а гідроксипролін знайдений також у клітинних стінках рослин. 6-N-метиллізин є складовою скоротливого білка міозину. Деякі білки, які зв'язують іони кальцію, наприклад, протромбін, містять γ-карбоксиглутамат. Десмозин — складна амінокислота, що утворюється із чотирьох залишків лізину — знайдена у фібрилярному білку еластині. Багато залишків амінокислот можуть бути посттрансляційно модифіковані тимчасово з метою регуляції функції білків. До таких модифікацій належить приєднання фосфтаних, метильних, ацетильних, аденільних, АДФ-рибозильних та інших груп.
Особливий випадок становить рідкісна амінокислота селеноцистеїн, що є похідним цистеїну, але замість атому сульфуру містить селен. На відміну від багатьох інших нестандартних амінокислот, які входять до складу білків, він утворюється не внаслідок модифікації залишку у вже готовому поліпептидному ланцюгу, а включається у нього під час трансляції. Селеноцистеїн кодується кодоном УГА, що за звичайних умов означає кінець синтезу. Подібно до селеноцистеїну піролізин, що використовується деякими метаногенними бактеріями при виробленні метану, кодується у цих організмів стоп-кодоном, але в цьому випадку УАГ.
Бактерії та рослини синтезують незвичайні амінокислоти, які можуть входити до складу пептидних антибіотиків (нізин, аламетицин); лантіонін — моносульфідний аналог цистину — спільно з ненасиченими амінокислотами входить до складу лантибіотиків (пептидні антибіотики бактеріального походження). d-амінокислоти входять до складу коротких (до 20 залишків) пептидів, що синтезуються ензиматично, а не на рибосомах. Ці пептиди у найбільшій кількості зустрічаються у складі клітинних стінок бактерій, завдяки чому останні є менш чутливими до дії протеаз. d-амінокислоти містять також деякі пептидні антибіотики, наприклад валіноміцин, граміцидин A, актиноміцин D.
Всього у живих клітинах зустрічається близько 700 різних амінокислот, багато із яких виконують самостійні функції. Наприклад, орнітин і цитрулін є ключовими метаболітами у циклі сечовини і шляху біосинтезу аргініну, гомоцистеїн — проміжний продукт метаболізму деяких амінокислот, S-аденозилметіонін – відіграє роль метилюючого агенту. 1-аміноциклопропан-1-карбоксильна кислота (АСС) — невелика за молекулярною масою широко розповсюджена циклічна амінокислота, що виступає проміжним продуктом в синтезі рослинного гормону етилену. У рослин, грибів і бактерій знайдено велику кількість амінокислот, функції яких досі не з'ясовані, проте оскільки більшість із них отруйні (наприклад, азасерин і β-ціаноаланін), вони можуть мати захисну роль. Деякі з амінокислот також знайдені і в метеоритах, особливо в карбонових хондритах.
Незамінні амінокислоти
Рослини та деякі мікроорганізми можуть виробляти всі амінокислоти, потрібні їм для синтезу клітинного білку. Тваринні організми здатні синтезувати лише 10 протеїногенних амінокислот. Останні 10 не можуть бути отримані за допомогою біосинтезу і повинні постійно надходити у організм у вигляді харчових білків. Відсутність їх у організмі призводить до загрозливим життю явищам. До таких амінокислот належать: аргінін, гістидин, ізолейцин, лейцин, лізин, метіонін, фенілаланін, треонін, триптофан, валін.[1]Функції амінокислот
На додаток до синтезу білків, стандартні і нестандартні амінокислоти в тваринному організмі виконують багато інших важливих біологічних функцій. Гліцин та глутамат (аніон глутамінової кислоти) використовуються як нейромедіатори при нервовій передачі через хімічні синапси, нейромедіаторами також є нестандартна амінокислота гамма-аміномасляна кислота, що є продуктом декарбоксилювання глутамату, дофамін — похідне тирозину, і серотонін, який утворюється із триптофану. Гістидин є попередником гістаміну – локального медіатора запальних і алергічних реакцій. Йодовмісний гормон щитоподібної залози тироксин утворюється із тирозину. Гліцин є одним із метаболічних попередників порфіринів (таких як дихальний пігмент гем).Деякі з 20-ти протеїногенних амінокислот називаються «незамінними» — це такі, що не виробляються в організмі і повинні надходити з їжею. Для людини це лізин, лейцин, ізолейцин, метіонін, фенілаланін, треонін, триптофан, валін, а для дітей також гістидин та аргінін.
Утворення пептидного зв'язку
Пептидний зв'язок між лейцином і треоніном у складі білка (кульково-стрижнева модель)
Пептидний зв'язок незалежно одне від одного описали у 1902 році Еміль Фішер і Франц Гофмейстер.
Дипептид має два кінці: N-, на якому розміщена аміногрупа, і C-, на якому розміщена карбоксильна група. Кожен із них потенційно може брати участь у наступній реакції конденсації, з утворенням лінійних три-, тетра-, пента- і так далі пептидів. Ланцюжки, що містять 40 і більше послідовно сполучених пептидними зв'язками залишків амінокислот, називаються поліпептидами. Молекули білків складаються із одного або кількох поліпептидних ланцюгів.
Кислотно-основні властивості амінокислот
Амінокислота у неіонізованій (зліва) і цвітеріонній формі (справа)
Криві титрування амінокислот
Крива титрування 0,1 М розчину гліцину при 25 °C гідроксидом натрію. Один еквівалент [OH-] = 0,1 моль NaOH.
Важливою особливістю амінокислот є те, що їхні карбоксильні групи є «більш кислотними», а аміногрупи «менш основними», ніж ці ж групи в складі сполук, в яких вони приєднані до аліфатичних вуглеводневих залишків. Наприклад, pKa оцтової кислоти становить 4,8, а pK1 гліцину — 2,34, pKa метиламіну — 10,6О, а pK2 гліцину — 9,60. Обидві групи легше віддають протони внаслідок їх взаємного впливу одна на одну. Цей вплив значно ослаблюється із збільшенням відстані між хімічними групами, тому β- і γ- карбоксильні групи аспарагінової і глутамінової кислот мають значення pKa ближчі до таких в інших карбонових кислот, а саме 3,90 і 4,07 відповідно.
Амінокислоти із зарядженими бічними ланцюгами мають дещо складніші криві тритрування, які складаються із трьох фаз, в таких амінокислот, відповідно, є три значення константи кислотної дисоціації.
Ізоелектрична точка
Для амінокислот, що не містять груп здатних до іонізації у бічних ланцюгах, ізоелектричну точку можна розрахувати як середнє арифметичне між константами кислотної дисоціації карбоксильної та аміногруп:В амінокислот із позитивно або негативно зарядженими бічними ланцюгами додаткові групи, здатні до іонізації, роблять свій внесок у значення pI: у «кислих» амінокислот воно нижче, а в «основних» вище, ніж в решти.





Немає коментарів:
Дописати коментар